鸽新城疫(PigeonNewcastledisease)又称鸽Ⅰ型副粘病毒(PigeonParamyxovirusⅠ,PPMV-Ⅰ)病,是一种由PPMV-Ⅰ引起的一种高度接触性传染病,目前该病毒被归为基因VIb亚型,其基因组为单股负链RNA,而基因VIb亚型可分为VIb1和VIb2两个分支,其中VIb1中毒株又可分为欧洲早期(EU/er)、欧洲近期(EU/ea)、北美(NA)和伊拉克(IQ)4个亚分支[1].
虽然PPMV-1仅有1个血清型,但是不同毒株间毒力差异很大[2].该病于20世纪70年代末首发于中东地区,并于1985年传入我国香港,同年8月珠海拱北动物检疫局从台湾引进种鸽中检出PPMV-Ⅰ[3].随着经济的发展,我国的信鸽、肉鸽以及观赏鸽的养殖规模迅速扩大,导致了PPMV-Ⅰ病的流行,成为威胁养鸽业的一个重要疫病。目前我国分离到的鸽源NDV大部分为VIb亚型,该型病毒具有明显的宿主亲嗜性;而融合蛋白(F)是NDV重要的毒力因子,是NDV分子生物学研究的重点[4-6],本研究对在鸽群中分离到的7株鸽源NDV的部分生物学特性进行测定,并基于F基因序列对其进行遗传进化分析,以期为鸽ND的防制提供理论依据。
1、材料与方法
1.1 鸡胚、阳性血清、试剂RNA提取试剂盒购自原平皓公司,ND标准阳性血清,H5、H9亚型禽流感标准阳性血清由扬州大学传染病实验室制备。AMV反转录酶、RNA酶抑制剂、Taq酶均购自Promega公司。DNA胶回收试剂盒购自Axygen公司。引物由上海生工生物工程技术服务有限公司合成。

1.2 病毒的分离鉴定无菌采集发病鸽的脾、脑、肺、胰腺等组织,后向无菌采集的病料加入1mL四抗PBS,使用高速匀浆机匀浆,组织悬液反复冻融3次后,8000r/min离心5min后,取组织上清接种10日龄SPF鸡胚,0.2mL/胚。接种后定时照胚,弃去24h以内死胚,收集24h以后的死胚,置于4℃冰箱充分冷却收尿囊液,测HA效价,无效价者继续盲传3代。收获尿囊液后,测得其HA效价,若有HA效价,则使用NDV及H5、H9阳性血清进行HI试验。HA及HI试验按照OIE推荐方法进行。病毒纯化使用次代鸡胚成纤维细胞(CEF)以空斑法纯化病毒,连续纯化3代后,挑蚀斑接种10日龄SPF鸡胚,收集24h后的死胚,测得HA效价为阳性者,收取尿囊液,置-70℃保存。
1.3 病毒RNA提取及反转录参照原平皓生物公司EASYspin组织/细胞RNA快速提取试剂盒的说明书提取7株NDV的RNA.反转录体系为:33μL洗脱液与3μL6碱基引物置70℃水浴反应10min;后再加入10μLRTbuffer、2μLdNTPs、1μLAMV反转录酶、1μLRRI,置42℃水浴反应2.5h.
1.4 RT-PCR反应根据GenBank上公布的NDV各基因型的F基因序列设计F片段的通用引物,扩增包含F基因完整ORF的片段,引物序列如下:F1:5′-AAAACACGGGTAGAAGAGTCTGGAT-3′;F2:5′-CTTAAATCTTCCATTGAACAGGTTG-5′。其中PCR反应参数为:10×PCR缓冲液2.5μL,dNTP0.5μL,上、下游引物各0.5μL,Taq酶0.5μL,模板3μL,加SW至25μL.循环参数:94℃预变性3min;94℃变性30s,58℃退火30s,72℃延伸2min,共25个循环;最后72℃充分延伸10min。
1.5 PCR产物回收和测序PCR反应产物在1%琼脂糖凝胶中进行电泳,电泳完成后胶回收,按照Axygen凝胶回收试剂盒说明回收PCR产物,回收产物全部送南京金斯瑞生物科技有限公司测序。
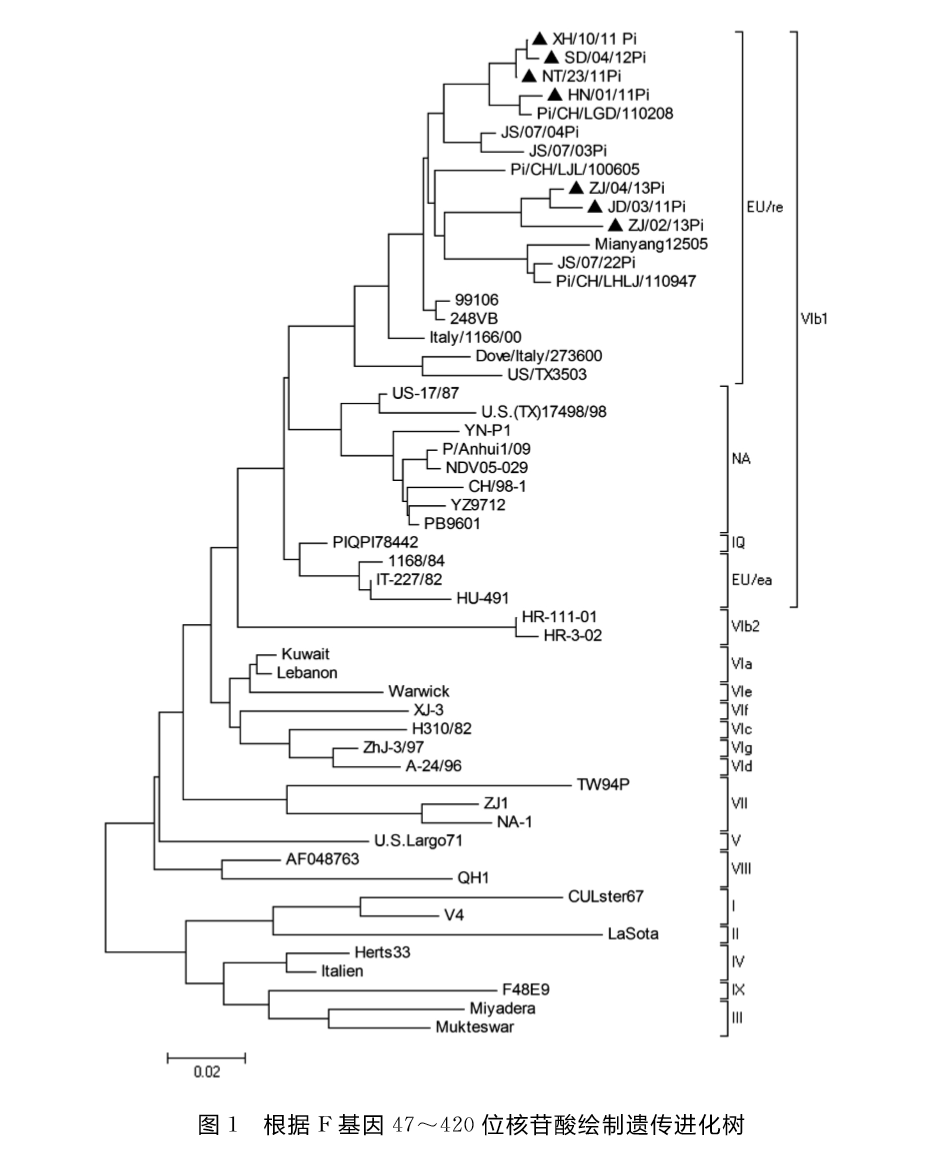
1.6 病毒F基因片段的序列分析测序后以基因分析软件DNAStar和MEGA5分析测序结果,将这7株所测定的分离株的F基因序列与其他在GenBank上已有的部分NDV代表株的F基因片段作序列比较,分析F基因的同源性,并根据F基因47~420位核苷酸绘制系统发育进化树。
2、结果
2.1 病毒的分离鉴定经尿囊腔接种病料上清的第一代SPF鸡胚均不死亡,且无HA效价,盲传1代后7株分离毒均有HA效价。分离毒株均可被ND阳性血清所抑制,而不能被H5、H9亚型禽流感病毒阳性血清抑制。7株分离株部分生物学特性(表1)。
2.2 F基因的扩增及序列测定与遗传进化分析用NDV通用引物扩增F基因片段,可获得1700bp左右的条带,使用MeaAlign软件比较7株分离株F基因的同源性,可以发现,本研究中7株分离毒同源性较高,江苏、浙江、山东分离株的核苷酸序列同源性在97.5%~99.5%之间;而7株分离株与我国广泛使用的疫苗株Lasota相比,核苷酸序列的同源性为83.9%~84.7%(表2)。
基于F基因47~420位的遗传进化分析(图1)表明本研究中的7株NDV均属VIb亚型,国内外的VIb亚型NDV可分为VIb1、VIb2两个分支,本研究中的7株VIb亚型NDV均处VIb1的EU/re这一分支[1],但是7株VIb亚型NDV与我国目前广泛使用的疫苗株Lasota遗传距离较远。
2.3 F蛋白氨基酸位点分析测序结果表明,所扩增的5株分离株的ORF长度均为1662bp,编码533个氨基酸。使用Lasergene中的MeaAlign软件对本次的7株分离株进行分析,结果表明,7株病毒在F蛋白均含有13个保守的C残基;F蛋白一级结构中含有5个潜在的糖基化位点,分别位于膜外区的85、191、366、447、471位氨基酸和膜内区的541位氨基酸。另外,7株病毒F蛋白的第132、259、380位氨基酸分别为S、H、N,有别于其他基因型的NDV,与文献[7]报道一致。7株病毒的F蛋白裂解位点氨基酸序列均为112RRQKRF117,是典型的NDV强毒株F蛋白裂解位点的氨基酸组成,但是7株分离株的MDT从50~96h不等,ICPI从0.98~1.51不等,说明其毒力并不一致,因此F蛋白裂解位点序列并不是NDV毒力的唯一决定因素。
3、讨论
遗传进化分析结果表明,本研究中的7株NDV病毒均属VIb亚型。核苷酸和氨基酸序列同源性分析表明,7株分离株之间同源性较高,推测这7株病毒具有共同起源。但7株分离株与目前广泛使用的疫苗株Lasota遗传距离较远,这也许是免疫鸽群发生感染的原因之一。

VIb亚型NDV又可被分为两个分支,即VIb1、VIb2,本研究的中7株VIb亚型NDV均处于VIb1中的EU/re这一分支,说明这几株VIb亚型NDV与欧洲型毒株有着比较近的遗传关系。符子华[8]等从新疆分离到的3株VIb亚型NDV同样与Italy/1166/00、99106(France)最接近,认为新疆鸽源NDV流行株与欧洲型毒株有着共同的起源,综合已有报道可以发现近些年的鸽源VIb亚型NDV分离株中EU/re这一分支的毒株占主要优势。而刘华雷等[9]报道的VIb亚型NDV分离株NC9701、YZ9712、PB960、黎俊君等[10]报道的2株广东分离株NDV/GD-1与NDV/GD-3均处于VIb1的NA分支,年代最近的NA分支国内分离株为2009年于安徽分离到的P/Anhui1/09,因此NA分支的VIb亚型NDV在我国依然存在。基因VIb亚型NDV的F蛋白裂解位点的氨基酸序列呈现多样性,我国VIb亚型NDV分离株F蛋白裂解位点序列有112RRQKRF117、112RRQKRF117和112KRQKRF1173种,本研究中7株VIb亚型NDV的F蛋白裂解位点均为112RRQKRF117,呈典型的强毒特征。虽然本研究中7株分离株裂解位点均呈现强毒特点,但ICPI值差异较大,说明其毒力由多种因素共同决定,这与Dortmans等[11]观点一致。
研究表明VIb亚型NDV具有明显的宿主亲嗜性,尤其对雏鸽危害很大,成年鸽感染后排毒可达2周;SPF鸡攻毒后,虽然并不能使SPF鸡出现临床症状,但是也可检测到排毒[12].Dortmans等[13]发现将PPMV-1在鸡体内多次传代后ICPI由0.44升至0.90,因此VIb亚型NDV必须引起我们的重视,鸽群与鸡群需严格隔离饲养。
国内的VIb亚型NDV病毒来源并不一致,既有欧洲型又有美洲型,并且也并没有因为地理位置的不同而表现出明显的差异,推测这与候鸟迁徙、信鸽比赛以及引种等有关。目前VIb亚型NDV仍然为鸽群中ND的优势流行株,并且存在对鸡毒力增强的潜在风险,需提高警惕。此外,VIb亚型NDV与广泛使用的疫苗株Lasota同源性不高,并且现有的血清学研究表明LaSota血清不能有效中和VIb亚型NDV[7,14],因此需研制和推广针对信鸽VIb亚型巴拉米哥(NDV)感染的新型疫苗。

保尔康1号,真正的鸽源巴拉米哥抗原提取,信鸽VIb亚型巴拉米哥疫苗,让您的爱鸽远离新城疫、甩拉吐的困扰,公棚采用保尔康1号注射免疫,0歪头率,公棚3月份首次接种免疫后8个月,检测赛鸽体内抗体效价仍维持在log7以上,可确保公棚全年无忧,不会出现决赛结束后大批奖鸽发病死亡等事故,经18年国内20多家公棚使用,确认效力完美,敬请放心!
参考文献:
[1] UJVA′RI D,WEHMANN E,KALETA E F,et al.Phylogenetic anal y sis reveals extensive evolution of
avianparamyxovirus t ype 1strains of p i geons(Columba livia)and suggests multi p le species transmission[ J]. Virus Res,2003,96( 1 -2):64 -74.
[2] ALEXANDER D J,RUSSELL P H,PARSONS G,etal.Anti genic and biological characterization of avianparamyxovirus t ype I isolate from p i geon -An interna-tional collaborative study[ J].Avian Pathol,1985,14 ( 3):365 -376.
[3] 李德厚、刘文灿、陈琨等,从进口种鸽多次检出鸽新 城疫病[ J].中国兽医杂志,1988,14( 6):54 -55.
[4] DORTMANS J C,KOCH G,ROTTIER P J,et al.Acomparative infection study of p i geon and avian pa- ramyxovirus type 1 viruses in p i geons:evaluationofclinical si gns,virus shedding and seroconversion[ J].A- vian Pathol,2011,40( 2):125 -130.
[5] COLLINS M S,STRONG I,ALEXANDER D J,et al.Pathogenicit y and phylogenetic evaluation of the vari- ant Newcastle disease termed" p i geon PMV-1"virusesbased on the nucleotide se quence of the Fusion p rotein gene[ J].Arch Virol,1996,141:635 -647.
[6] TOYODA T,SAKAGUCHI T,HIROTA H,et al.Newcastle disease virus evolutionⅡ。Lack of gene re
-combination in generating virulent and avirulent strains [ J].Virology,1989,169:273 -282.
[7] 朱杰、赵晴晴、陈广仁等,免疫鸽群中2株新城疫病
毒的分离鉴定及遗传进化分析[ J].中国兽医科学, 2012,42(10):998 -1001.
[8] 符子华、龚国华、易忠等,三株鸽新城疫病毒新疆分 离株F基因序列分析及遗传起源探讨[ J].中国预防兽 医学报,2007,29(10):777 -781.
[9] 刘华雷、周斌、郁斌等,五株鸽副黏病毒国内分离 株F基因片段的克隆和分子特性[ J].病毒学报,2004, 20( 4):378 -381.
[10] 黎俊君、何琴、焦培荣等,四株广东鸽源新城疫病 毒的生物学特性[ J].中国兽医科学,2011,41( 7):677 -683.
[11] DORTMANS J C,KOCH G,ROTTIER P J,et al.Virulence of p i geon paramyxovirus t ype 1(PPMV-1)
not alway s correlates with the cleavabilit y of its fu- sion p rotein[ J].J Gen Virol,2009,90(11):2746-2750.
[12] 胡北侠、杨少华、张会娟等,鸽源新城疫病毒全基因 组序列分析及致病性研究[ J].畜牧兽医学报,2014, 45( 2):255 -261.
[13] DORTMANS J C,ROTTIER P J,KOCH G,et al. Passaging of a Newcastle disease virus p i geon variant in chickens results in selection of viruses with muta
-tions in the pol ymerase complex enhancing virus rep- lication and virulence[ J].J General Virol,2011,92,336 -345.
[14] 李仕超、仇旭升、刘开春等,六株鸽源新城疫病毒的分离、鉴定及生物信息学分析[J].中国动物传染病学 报2014,22( 5): 1 -9.